Une pandémie d’influenza aviaire hautement pathogène ravage depuis quelques mois les populations aviaires. Dans cet article, je vous propose de reprendre les bases de cette zoonose désastreuse pour la conservation des espèces comme pour les filières d’élevage.
Présentation
Une pandémie d’influenza aviaire hautement pathogène provoque actuellement une mortalité élevée chez les oiseaux Palmipèdes et Galliformes. Une situation catastrophique pour la conservation de certaines espèces sauvages. L’influenza aviaire est une épizootie virale qui sévit principalement sous sa forme hautement pathogène et mortelle chez les taxons précédemment nommés. En cas de transmission à l’homme, cette zoonose se nomme grippe aviaire.
Pour le moment, la transmission de l’animal vers l’homme est encore rare mais possible. La contamination d’homme à homme n’est pas encore rapportée, mais les virus influenza pouvant muter facilement, la crainte d’une pandémie demeure.
Le virus H5N1
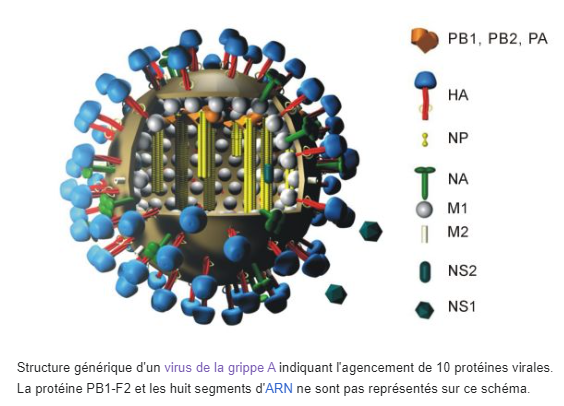
Le virus de l’influenza est un virus à ARN simple brin faisant partie des Ribovirus. Il en existe quatre types selon la biochimie de leurs antigènes : A, B, C et D. Pour information ces antigènes sont des protéines de l’enveloppe virale et des nucléoprotéines. Les virus influenza de type A sont les plus redoutés, car ils sont à l’origine des grandes pandémies comme la grippe espagnole. Ce sont nos grippes saisonnières. Ils sont tout autant responsables de l’influenza aviaire que des grippes canines, porcines et équines.
Chez les Oiseaux, les virus influenza de type A infectent une large liste d’espèces, mais ils sont surtout pathogènes pour les oiseaux d’eau. Ces derniers sont ainsi considérés comme hôtes réservoirs et surveillés de près, domestiques comme sauvages. Les virus influenza de type A sont eux-mêmes répartis en sous-types selon la biochimie de deux protéines de leur enveloppe virale : l’hémagglutinine (HA ou H) et la neuraminidase (NA ou N). Il existe chez les oiseaux 16 HA et 9 NA différents.
Chaque combinaison crée potentiellement une nouvelle souche virale, et il existe 144 combinaisons possibles ! Par exemple, A(H5N1) est le virus de l’influenza type A, hémagglutinine 5 et neuraminidase 1. Et ainsi de suite.
Un peu de biologie moléculaire
Les virus de l’influenza sont des virus ARN simple brin de polarité négative. C’est à dire que les 8 segments ARN de leur génome ne peuvent pas être traduits directement en protéines virales, il faut que l’ARN viral soit répliqué de manière complémentaire. Comme le négatif d’une photographie. Pour cela le virus possède dans son enveloppe virale une enzyme particulière dite ARN polymérase ARN-dépendante. Cette enzyme cruciale va se charger automatiquement, une fois le virus à l’intérieur de la cellule, de répliquer le brin complémentaire à l’ARN négatif viral. Grâce à cette enzymes, les réplications d’ARN « positives » sont lues comme des ARN messagers par la cellule infectée, qui va alors produire massivement des protéines virales. Puis par bourgeonnements libérer des nuées de nouveaux virions.
Le génome d’un virus de l’influenza mesure en moyenne 13.500 bases azotées. Or l’ARN polymérase n’est pas une enzyme parfaite. Lorsqu’elle réplique de l’ARN négatif, elle effectue une erreur d’insertion de nucléotide complémentaire toutes les 10.000 bases environ. Aussi, chaque nouveau virion a statistiquement au moins une erreur conservée dans son génome, qui si répliquée deviendra alors une mutation virale. Donc quand le virion infectera une cellule-hôte, alors cette mutation s’exprimera peut-être pour donner une protéine mutante.
Dans ces conditions, les taux de virions mutants générés au cours d’une épidémie sont suffisamment importants pour qu’il y ait potentiellement sélection naturelle puis propagation de nouveaux mutants d’un individu à l’autre. C’est pourquoi les virus de l’influenza peuvent, lorsqu’ils se propagent au sein de populations réservoirs, potentiellement muter pour faire émerger une nouvelle souche dont la pathogénicité et la transmissibilité restent à découvrir ! Au dépens des oiseaux hôtes. Dans le cas des virus de l’influenza de type A, tous les sous-types peuvent infecter les oiseaux, sauf A(H17N10) et A(H18N11), dépistés uniquement chez les chauve-souris.
L’effet creuset
Comment apparaît un sous-type viral pathogène chez l’homme comme chez les animaux ? Nous avons vu le cas des mutations par erreurs de réplication virale. Mais il existe aussi une autre possibilité en biologie moléculaire.
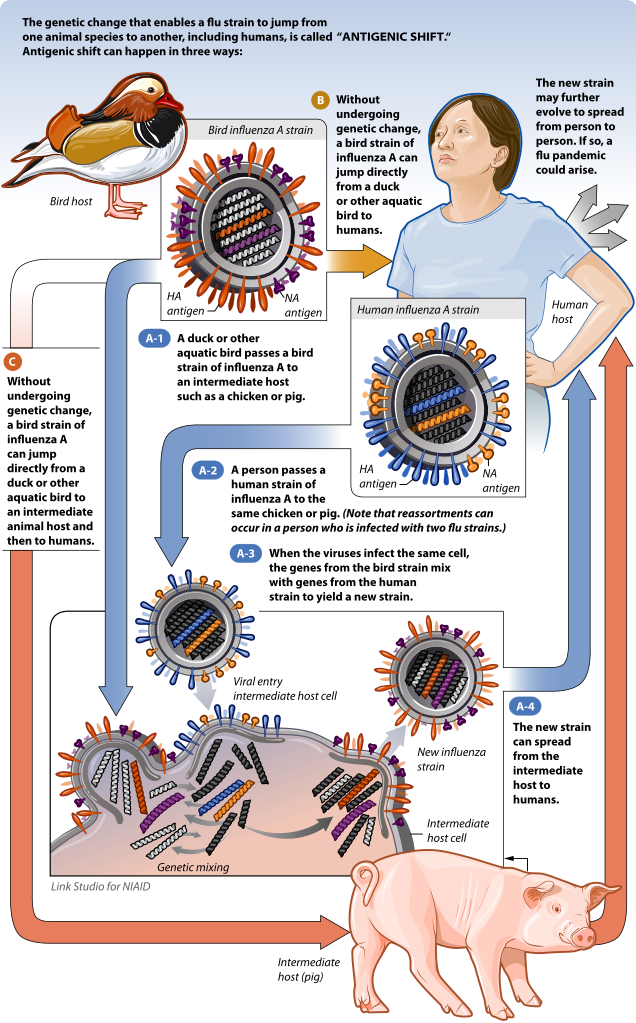
Le virus A(H5N1) comme tous les virus à ARN, présente une grande capacité à muter par ce mécanisme. Mais en cas de co-infection à l’influenza aviaire et à la grippe humaine, il n’est pas impossible que les deux virus influenza type A se recombinent dans leur cellule-hôte. Il s’agit de la cassure antigénique, un processus moléculaire par lequel deux ou plusieurs souches virales peuvent se recombiner en mélangeant les antigènes de surface sur de nouveaux virions hybrides. C’est un cas particulier de réassortiment viral déjà étudié par exemple dans le cas de co-infections aux virus de la grippe humaine. La structure segmentaire du génome ARN viral permet le réassortiment génétique dans des cellules co-infectées.
Ce mécanisme aboutit à la création au hasard de nouveaux virions, présentant de nouvelles caractéristiques pathogènes, ou non-infectieuses parce que tronquée de segments génétiques nécessaires. La cassure ou changement antigénique, ce fameux « creuset », ne doit pas être confondue avec la dérive antigénique, qui concerne les mutations accumulées à chaque réplication virale. Mais creuset et erreurs de réplication peuvent se cumuler et se réaliser simultanément !
La cassure antigénique
La cassure antigénique ouvre la voie à l’infection de nouveaux taxons. C’est un moteur important pour expliquer comment une épizootie peut devenir une zoonose. Un scénario préoccupant en Asie où les élevages de poulets et de porcs sont souvent en très grande promiscuité. En fait, des exemples de cassure antigénique pour l’influenza de type A ont déjà eu lieu par le passé. Comme la pandémie de grippe asiatique de 1957, la grippe de Hong-Kong de 1968 et la grippe porcine de 1976 (Mccaughey, 2010). L’hôte servant le plus souvent de creuset dans ces exemples est le porc, car sensible aux virus influenza type A aviaires, porcins et humains, il est propice aux co-infections.
Le porc est d’ailleurs un animal très sensible aux influenza type A (Sandbulte et al., 2015). En Asie par exemple, les élevages intensifs et/ou mixtes, filières de transport ou encore étals de marchés asiatiques, dans tous les cas favorisant une forte promiscuité et à faible hygiène sont des conditions propices à la co-infection virale et multiplient ces risques. A noter que la fameuse grippe espagnole de 1918-1920 (25-50 millions de décès) a pour origine la dérive antigénique d’un virus d’influenza aviaire en virus de grippe humaine ! Le « creuset » n’est donc pas obligatoire pour des zoonoses.
Une pathogénicité variable pour des virus liés aux activités anthropiques
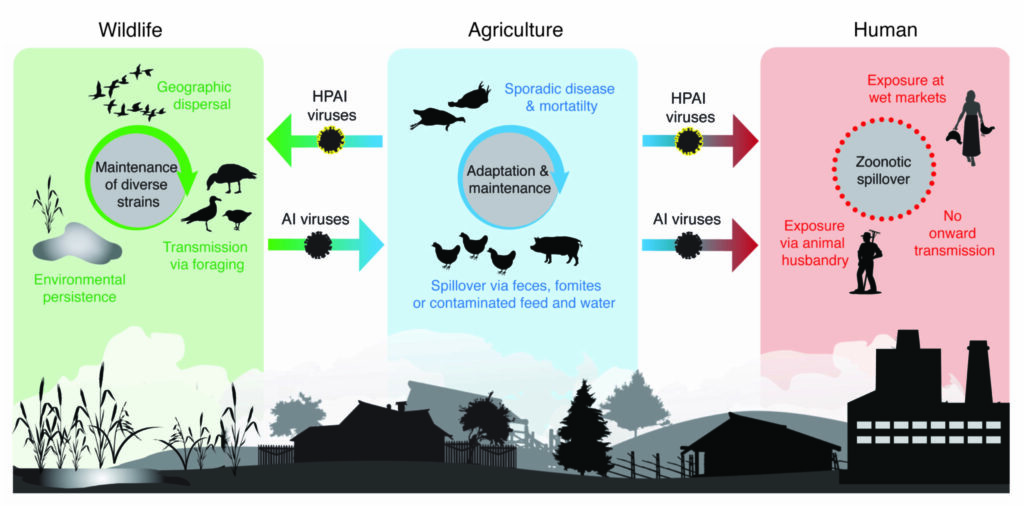
Les virus de l’influenza de type A se classent en deux catégorie. Ceux à faible pathogénicité ou « low pathogenicity avian influenza (LPAI) A viruses », et ceux très pathogènes ou « highly pathogenic avian influenza (HPAI) A viruses ». Les LPAI peuvent contaminer les oiseaux sauvages et domestiques mais sont le plus souvent asymptomatiques. Cependant, ces virus peuvent muter en types HPAI (voir explications précédentes) et représentent donc une menace potentielle. Les HPAI hautement pathogènes ont des taux de mortalité supérieurs à 90%. Seuls les sous-types de l’influenza A(H5) et A(H7) entrent dans cette catégorie. Certains oiseaux sont cependant asymptomatiques, mais peuvent contribuer à leur diffusion par les voies migratoires.
De nouvelles souches mutantes de virus de type A changeant de catégories LPAI vers HPAI peuvent émerger dans les élevages intensifs de volaille. C’est un scénario rapporté dans une forte majorité de cas (Dhingra et al., 2018). C’est aussi le scénario convenu pour l’origine commune de toutes les souches mutantes actuelles d’influenza aviaire (Xu et al., 1999). Elles proviennent d’une ferme d’oies domestiques dans la province de Guangdong, en Chine, en 1996. L’origine anthropique de ces souches mutantes ne fait donc aucun doute.
Les souches virales issues de cette lignée sont hautement pathogènes et provoquent une mortalité élevée chez les oiseaux domestiques comme sauvages. Ce seraient, en résumé, les descendants mutants de cette lignée qui circuleraient activement dans la nature et les élevages.
La faune sauvage menacée
Cette année, la pandémie s’est installée dans les colonies d’oiseaux marins : Fous de Bassan, Sternes, Grands labbes et Pélicans. Ces espèces, durement touchées, mettront des années pour rétablir les effectifs de leurs populations. Actuellement, les services sanitaires des pays touchés par la pandémie de HPAI ne signalent que des oiseaux sauvages infectés et trouvés morts. Ce qui signifie que l’ampleur réel et la propagation de cette HPAI nous sont encore inconnus.
Comme le virus semble circuler facilement entre différentes espèces d’oiseaux, l’exposition directe d’oiseaux d’élevage à des oiseaux sauvages semble la voie de transmission la plus probable du virus. Il est donc crucial de limiter l’exposition aux oiseaux sauvages afin de réduire le risque d’introduction de l’influenza aviaire dans les élevages. Une mesure difficile pour bon nombre d’éleveurs, cela se conçoit.
La situation en France
En France, la DGS (direction générale de la santé) a élaboré un plan gouvernemental de lutte qui fait frémir tous les éleveurs et sauvaginiers : la suppression de tous les réservoirs aviaires susceptibles de contribuer à la propagation de l’épidémie. Si le virus frappe un élevage de volailles, le vide sanitaire est obligatoire. Abattage systématique de poulets et autres volailles. En cas de besoin, le plan inclut d’étendre la mesure aux autres élevages de volailles dans un rayon fixé par les autorités vétérinaires. En cas de pandémie, et notamment de zoonoses puis de transmissions d’homme à homme, nous revivrions un confinement de grande envergure.
Existe-t-il un vaccin ?
Un vaccin pour protéger les animaux domestiques ? Hélas actuellement, aucun vaccin n’est disponible pour lutter intégralement contre les différents sous-types HPAI. Le seul vaccin autorisé pour le moment en France, Nobilis, n’est efficace que contre le sous-type A(H5N2) chez la Poule domestique !
Le ministère de l’Agriculture a bien initié en mai dernier une expérimentation destinée à vacciner les palmipèdes, mais les premiers résultats quant à l’efficacité du vaccin ne seront pas connus avant le premier semestre 2023. Les deux vaccins sélectionnés sont ceux des laboratoires Ceva Santé Animale et Boehringer Ingelheim. Différents financeurs publics et privés (filières d’élevage notamment) participent aux études actuelles.
Vers une vaccination des volailles d’élevage
La première phase est réalisée sur sites d’élevage. Des animaux sont vaccinés et leur réponse à la vaccination expérimentale est étudiée pendant les 12 à 13 semaines d’élevage. Le principe ? L’antigène contenu dans le vaccin expérimental déclenche une réponse immunitaire primaire. Les anticorps spécifiques augmentent via la sélection de lymphocytes B. A la prochaine exposition à l’antigène, la réponse immunitaire secondaire sera plus forte.
La deuxième phase est réalisée dans les animaleries confinées du Laboratoire national de référence de l’Anses à Ploufragan (LNR). Objectif : tester cette réponse immunitaire secondaire par injection de virus de l’influenza hautement pathogène. La France n’est pas le seul Etat membre de l’Union européenne à tester des vaccins : les Pays-Bas et la Hongrie, par exemple, ont aussi lancé des expérimentations vaccinales sur leur territoire. Nous verrons bien qui aboutira en premier. Néanmoins il faudra encore attendre encore longtemps avant qu’un vaccin ne efficace soit diffusé aux animaux d’élevage. Certains pays comme le Japon, les Etats-Unis et le Canada interdisent formellement l’importation d’animaux vaccinés.
Enfin, si la vaccination des volailles soulagera forcément la filière élevage, elle ne résoudra en rien l’impact catastrophique de la pandémie sur les oiseaux sauvages. Or combien d’espèces sauvages ne s’en remettront pas ?





